
LA RICERCA SIAMO NOI
La ricerca clinica è fondamentale per lo sviluppo di nuove terapie e ha contribuito negli anni a salvare milioni di vite. Ogni traguardo raggiunto è il risultato di un percorso condiviso da medici, scienziati e pazienti, uniti nel comune obiettivo di migliorare la salute globale. La partecipazione dei pazienti agli studi clinici permette di accedere alle terapie più avanzate e, al tempo stesso, contribuire allo sviluppo di cure migliori per tutti. Ma come funziona la ricerca clinica? Quali tutele sono previste per i partecipanti? Cosa è necessario sapere prima di partecipare agli studi clinici?
LA RICERCA SIAMO NOI
La ricerca clinica è fondamentale per lo sviluppo di nuove terapie e ha contribuito negli anni a salvare milioni di vite. Ogni traguardo raggiunto è il risultato di un percorso condiviso da medici, scienziati e pazienti, uniti nel comune obiettivo di migliorare la salute globale. La partecipazione dei pazienti agli studi clinici permette di accedere alle terapie più avanzate e, al tempo stesso, contribuire allo sviluppo di cure migliori per tutti. Ma come funziona la ricerca clinica? Quali tutele sono previste per i partecipanti? Cosa è necessario sapere prima di partecipare agli studi clinici?
La campagna “La ricerca siamo noi. Tutti insieme dalla scienza alla cura” risponde a queste domande. L’iniziativa è promossa dall’Accademia del Paziente Esperto EUPATI APS (AdPEE) e da un network di 47 Associazioni Pazienti, Accademie e Centri di ricerca, con il patrocinio della Fondazione Policlinico Universitario Agostino Gemelli IRCCS – Università Cattolica del Sacro Cuore, del relativo Clinical Trial Center e dell’Azienda Ospedaliero – Universitaria di Alessandria e con la sponsorizzazione non condizionante di Pfizer, Alfasigma, Chiesi, Roche, BeiGene, Daiichi Sankyo | AstraZeneca, GSK, Kedrion Biopharma, Lilly Italia, MSD.
Un viaggio dietro le quinte della ricerca, attraverso video serie informative e testimonianze dirette dei pazienti esperti EUPATI, per migliorare la consapevolezza del valore della ricerca e favorire la partecipazione consapevole e informata agli studi.
Perché ogni persona ha un ruolo fondamentale nel progresso scientifico. La ricerca è speranza, innovazione, condivisione. La ricerca siamo noi.
LA STRADA VERSO LA CURA
Agrumi e marinai, muffe rivoluzionarie, “bombe” contro i tumori. Sono solo alcune delle scoperte che hanno messo a disposizione dell’umanità farmaci fondamentali per combattere le malattie. Ma come ci siamo arrivati?
Tutte le grandi innovazioni terapeutiche hanno alle spalle un percorso di ricerca e sperimentazione, che nei secoli è diventato sempre più rigoroso, mettendo al primo posto la sicurezza dei pazienti.
Con Marco Cattaneo, direttore di Le Scienze, ripercorriamo le tappe della ricerca dal laboratorio al paziente.
LA STRADA VERSO LA CURA
Agrumi e marinai, muffe rivoluzionarie, “bombe” contro i tumori. Sono solo alcune delle scoperte che hanno messo a disposizione dell’umanità farmaci fondamentali per combattere le malattie. Ma come ci siamo arrivati?
Tutte le grandi innovazioni terapeutiche hanno alle spalle un percorso di ricerca e sperimentazione, che nei secoli è diventato sempre più rigoroso, mettendo al primo posto la sicurezza dei pazienti.
Con Marco Cattaneo, direttore di Le Scienze, ripercorriamo le tappe della ricerca dal laboratorio al paziente.
VIAGGIO NELLA RICERCA
Intuizioni e esperimenti che hanno cambiato la storia della medicina.
VIAGGIO NELLA RICERCA
Intuizioni e esperimenti che hanno cambiato la storia della medicina.
COME NASCE LA CURA
Protagonisti, processi e regole che portano allo sviluppo di nuovi farmaci.
COME NASCE LA CURA
Protagonisti, processi e regole che portano allo sviluppo di nuovi farmaci.
DENTRO LA RICERCA
DENTRO LA RICERCA
Che cos'è la ricerca clinica
Gli studi clinici, o trial clinici, sono una parte fondamentale dello sviluppo di nuove terapie. Il loro obiettivo è verificare la sicurezza e l’efficacia dei nuovi farmaci, prima che siano messi a disposizione dei pazienti.
Per garantire le cure più appropriate ai futuri pazienti ogni nuova terapia deve superare diverse fasi di ricerca: dagli studi “in vitro” su cellule o microrganismi e “in vivo” sugli animali, agli studi clinici di fase 1, fase 2 e fase 3 eseguiti sull’uomo.
Ogni fase ha l’obiettivo di accertare che i benefici del nuovo farmaco siano superiori ai rischi di effetti collaterali ed è sottoposta a regole e controlli severi. Se il gruppo di ricerca verifica che i rischi prevalgono sui potenziali benefici, lo studio viene interrotto senza passare alla fase successiva.
Si tratta, quindi, di un processo molto lungo, complesso e costoso: sono necessari circa dodici anni e oltre 1 miliardo di euro per realizzare tutte le ricerche necessarie prima che un nuovo farmaco sia autorizzato per l’uso da parte dei pazienti. Su circa 10.000 composti studiati dai ricercatori soltanto uno, alla fine di questo processo, riesce ad arrivare ai pazienti come nuova terapia.
La verifica dell’efficacia e della sicurezza non si ferma con l’autorizzazione della nuova cura. Dopo che il farmaco è stato messo in commercio gli studi clinici di fase 4 e le attività di monitoraggio o farmacovigilanza permettono di raccogliere nuove informazioni che ci dicono quali sono gli effetti della terapia su una popolazione molto più ampia e nel lungo termine.
Perché partecipare agli studi clinici
Partecipare agli studi clinici permette di contribuire al progresso scientifico, rendendo possibile lo sviluppo delle future terapie. Al tempo stesso, la partecipazione alle sperimentazioni consente di accedere a cure innovative che sarebbero altrimenti inaccessibili.
I partecipanti agli studi clinici sono sottoposti a controlli approfonditi e le sperimentazioni sono condotte in centri ospedalieri d’eccellenza, in cui operano equipe mediche estremamente preparate.
La partecipazione agli studi clinici offre quindi ai pazienti la possibilità di ottenere le cure migliori per la propria condizione.
La ricerca preclinica
Lo sviluppo di nuovi farmaci e trattamenti parte dalla sperimentazione preclinica. Si tratta di una verifica preliminare che serve a capire come si comporta una molecola e qual è il suo livello di tossicità su un organismo vivente, prima di testarla sugli esseri umani.
Per prima cosa si effettuano studi in vitro: la nuova molecola viene testata in laboratorio su cellule o microrganismi. L’obiettivo è indagare le caratteristiche del principio attivo. Solo se si stabilisce che la molecola ha potenziali effetti terapeutici si passa agli studi sugli animali, ossia agli studi cosiddetti in vivo.
Obiettivo degli studi in vivo è verificare se l’efficacia della molecola dimostrata in laboratorio risulti confermata su modelli animali di patologie umane. Ad esempio, si valuta come il principio attivo venga assorbito e come viene espulso. Gli studi in vivo hanno anche l’obiettivo di verificare il profilo di sicurezza della molecola prima di iniziare gli studi sull’uomo.
La sperimentazione preclinica è essenziale per garantire che i farmaci che entrano nella fase clinica abbiano un profilo di sicurezza accettabile e una buona probabilità di essere efficaci.
I criteri e le procedure sono molto rigorosi: su 10.000 potenziali molecole, solo 5 riescono a superare la ricerca preclinica ed entrano negli studi clinici sull’uomo.
Gli studi di fase 1
Gli studi clinici iniziano con la fase 1, che ha l’obiettivo di fornire una prima valutazione della sicurezza e della tollerabilità della nuova molecola sull’uomo.
Per garantire un maggiore controllo su eventuali effetti indesiderati questi studi vengono condotti su un piccolo numero di volontari sani: tra 20 e 80. Gli studi hanno una durata da 1 a 2 anni.
I volontari vengono divisi in più gruppi. Ad ognuno viene somministrata una dose diversa, generalmente crescente, per individuare la relazione tra la dose ed eventuali effetti indesiderati e individuare la massima dose tollerata.
Gli studi di fase 2
Gli studi clinici di fase 2 offrono una prima valutazione dell’efficacia del farmaco sull’uomo, ossia di verificare se è in grado produrre sull’organismo umano i benefici clinici desiderati. Questa fase ha anche l’obiettivo di individuare la dose più efficace con minori effetti collaterali.
Gli studi di fase 2 sono condotti su pazienti volontari affetti dalla patologia per la quale il farmaco è in fase di sviluppo.
I partecipanti vengono suddivisi in gruppi che ricevono dosi differenti del farmaco. Alcuni possono ricevere un placebo, ovvero una sostanza priva di effetti terapeutici. Questo permette di capire se un eventuale miglioramento dipende effettivamente dalla molecola in studio o dalle aspettative del paziente e degli stessi medici.
La valutazione viene effettuata senza che i pazienti, ma anche i medici, sappiano chi ha ricevuto il trattamento e chi il placebo. Nel primo caso si parla di studio in cieco singolo, nel secondo di studio in doppio cieco.
Anche la fase 2 dura da uno a due anni e vengono coinvolti tra 100 e 200 pazienti volontari.
Gli studi di fase 3
Gli studi condotti in questa fase sono studi controllati randomizzati, in doppio cieco se possibile. Quindi i pazienti vengono divisi casualmente in due gruppi: uno riceve il nuovo principio attivo, l’altro un composto di controllo – placebo o altro farmaco in uso – oppure nessun trattamento.
L’attribuzione casuale ai due gruppi garantisce che non vi sia l’interferenza di criteri soggettivi o arbitrari nella composizione dei due gruppi. Né i pazienti né i medici sanno quale trattamento sarà somministrato a ciascun partecipante. In questo modo qualunque differenza nelle condizioni di salute dei partecipanti potrà essere attribuita esclusivamente al trattamento somministrato.
La somministrazione della molecola può durare mesi, mentre il monitoraggio degli effetti dura fino a 3-5 anni. A differenza delle fasi 1 e 2, in fase 3 il numero di soggetti coinvolti è molto più ampio: migliaia di pazienti. Ovviamente il numero dei partecipanti dipende dalla frequenza della malattia e sarà molto esiguo nel caso delle malattie rare.
Anche gli studi di questa fase prevedono un monitoraggio costante dei partecipanti, per identificare eventuali nuovi effetti collaterali: dalle fasi precedenti, sappiamo che la nuova molecola offre adeguati margini di sicurezza che devono essere continuamente verificati nelle fasi successive.
Se il farmaco supera anche la fase 3 l’azienda che lo ha sviluppato può chiedere alle autorità competenti l’autorizzazione all’immissione in commercio. Ma il viaggio della ricerca continua, con la fase 4.
Fase 4 e farmacovigilanza
Dopo l’immissione in commercio la nuova cura diventa disponibile per milioni di persone. Questo fa emergere ulteriori reazioni non rilevabili negli studi delle fasi precedenti, si manifestano quando il farmaco viene assunto da milioni di persone.
Il monitoraggio del farmaco continua dunque nella fase 4, quando la nuova terapia è disponibile per tutti. In questa fase si raccolgono informazioni importanti sulla sicurezza ed efficacia, cercando eventuali effetti collaterali rari non ancora descritti, interazioni non ancora note con altri farmaci e tutti i rischi e i benefici del trattamento a lungo termine.
In questa fase entra in gioco anche la farmacovigilanza, ossia la segnalazione di eventuali effetti indesiderati da parte di pazienti, medici e farmacisti. Queste segnalazioni permettono agli esperti di rilevare potenziali rischi o problemi e aiutano a preservare il profilo di sicurezza dei farmaci.
La fase 4 e la farmacovigilanza accompagnano l’intera vita del farmaco, per acquisire ulteriori informazioni sulla molecola e mantenere alta la guardia sulla sua sicurezza, proteggendo la nostra salute a lungo termine.
Come sono tutelati i pazienti
Ogni studio clinico, prima di iniziare, deve aver ricevuto una specifica autorizzazione dagli Enti regolatori nazionali, ad esempio Aifa in Italia, o FDA negli Stati Uniti. Parallelamente, il protocollo dello studio deve essere sottoposto al parere di un Comitato etico di ricerca, un organismo indipendente che ha l’obiettivo di garantire i diritti dei partecipanti e che comprende anche rappresentanti delle associazioni di pazienti.
La tutela dei partecipanti viene ulteriormente rafforzata dalle linee guida internazionali che regolano la conduzione di studi clinici: la Dichiarazione di Helsinki e le Good Clinical Practices, o GCP.
La Dichiarazione di Helsinki è stata sviluppata dall’Associazione Medica Mondiale e stabilisce che la ricerca sia effettuata secondo un metodo scientifico ben definito, a garanzia dei partecipanti agli studi. Afferma il rispetto dell’individuo e il diritto della persona all’autodeterminazione attraverso la possibilità di prendere decisioni informate sulla partecipazione alla ricerca.
Le Good Clinical Practices, note come GCP, sono le linee guida internazionali che regolano la conduzione di studi clinici: nell’Unione Europea, rappresentano il requisito legale per la conduzione delle sperimentazioni. Fissano gli standard di riferimento sulle modalità di conduzione degli studi, fondamentali per tutelare i pazienti e per assicurare che i risultati della ricerca siano scientificamente validi e fruibili dalla comunità scientifica internazionale.
Come partecipare agli studi clinici
Spesso sono i medici che informano i pazienti sull’esistenza di studi clinici.
Un altro riferimento fondamentale sono le associazioni di pazienti. Le associazioni, infatti, hanno un ruolo sempre più attivo negli studi clinici e sono spesso coinvolte fin dalla fase di progettazione.
Esistono, inoltre, siti internet dedicati. Ad esempio Clinical Trial Information System è il portale unico europeo dedicato alla ricerca clinica. È possibile fare riferimento anche ai registri degli studi clinici realizzati dagli stessi istituti di ricerca.
Il coinvolgimento attivo di pazienti e associazioni
Il primo e più importante è aiutare a far conoscere l’importanza degli studi clinici. Grazie alla partecipazione dei pazienti alle sperimentazioni la ricerca può andare avanti, permettendo un accesso più veloce a terapie innovative.
Il medico deve spiegare ai pazienti gli obiettivi, i metodi, i benefici previsti e i potenziali rischi della ricerca. In questo modo i pazienti, adeguatamente informati, possono firmare il consenso alla partecipazione allo studio.
Durante lo studio, i medici e i ricercatori devono continuare a fornire tutte le spiegazioni necessarie e in qualsiasi momento i partecipanti hanno il diritto di ritirarsi dallo studio clinico.
Una seconda modalità di coinvolgimento dei pazienti e delle loro associazioni nel processo di ricerca è la partecipazione attiva nella progettazione degli studi clinici, nell’interpretazione dei risultati e nella diffusione delle informazioni alle comunità di pazienti.
Coinvolgere i pazienti nelle fasi di pianificazione, esecuzione e valutazione degli studi può migliorare notevolmente i risultati. I pazienti, infatti offrono ai ricercatori una prospettiva unica, basata sull’esperienza con la patologia e i trattamenti disponibili. Il dialogo aperto tra ricercatori e pazienti crea un circolo virtuoso: i pazienti promuovono cure più mirate, e i ricercatori sviluppano terapie che rispondono ai bisogni concreti dei pazienti.
LA RICERCA PER ME
Cosa vuol dire partecipare a uno studio clinico? I pazienti esperti condividono le loro esperienze: motivazioni e paure, benefici e ostacoli, consigli e supporto. Tutto quello che è necessario sapere, dalla voce dei diretti protagonisti.
LA RICERCA PER ME
Cosa vuol dire partecipare a uno studio clinico? I pazienti esperti condividono le loro esperienze: motivazioni e paure, benefici e ostacoli, consigli e supporto. Tutto quello che è necessario sapere, dalla voce dei diretti protagonisti.
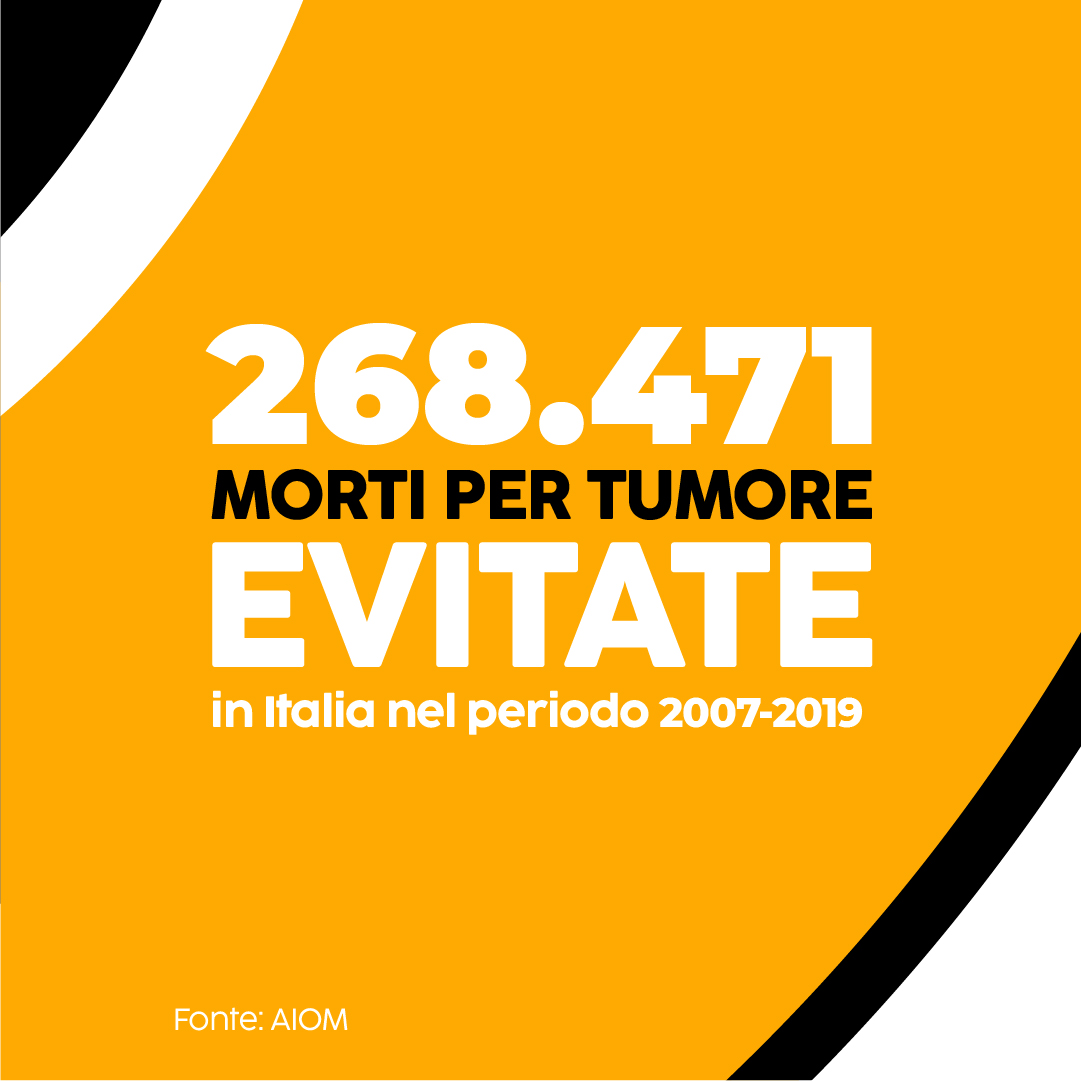
FATTI DI RICERCA
Il progresso scientifico ha un impatto sulla vita di tutti noi. Come? Ecco alcuni esempi.
FATTI DI RICERCA
Il progresso scientifico ha un impatto sulla vita di tutti noi. Come? Ecco alcuni esempi.





SEDE DI ROMA
Via Pietro De Francisci, 36
00165 Roma
C.F. 97811490586
+39 331-779.4113
team@accademiadeipazienti.it
MAIN PARTNER

